La cytométrie de flux (CMF) est un analyseur cellulaire qui mesure l'intensité de fluorescence des marqueurs cellulaires colorés. Il s'agit d'une technologie de pointe développée à partir de l'analyse et du tri de cellules individuelles. Elle permet de mesurer et de classer rapidement la taille, la structure interne, l'ADN, l'ARN, les protéines, les antigènes et d'autres propriétés physiques ou chimiques des cellules, et peut s'appuyer sur la collecte de ces classifications.

Le cytomètre de flux se compose principalement des cinq parties suivantes :
1 Chambre d'écoulement et système fluidique
2 Source de lumière laser et système de mise en forme du faisceau
3 Système optique
4 Système électronique, de stockage, d'affichage et d'analyse
5 Système de tri cellulaire
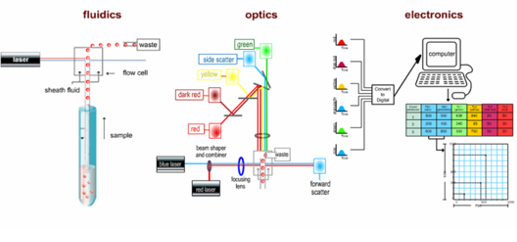
Parmi ces techniques, l'excitation laser dans la source lumineuse laser et le système de formation de faisceau constitue la principale mesure des signaux de fluorescence en cytométrie de flux. L'intensité de la lumière d'excitation et le temps d'exposition sont liés à l'intensité du signal de fluorescence. Le laser est une source de lumière cohérente capable de fournir un éclairage mono-longueur d'onde, de haute intensité et de haute stabilité. C'est la source lumineuse d'excitation idéale pour répondre à ces exigences.
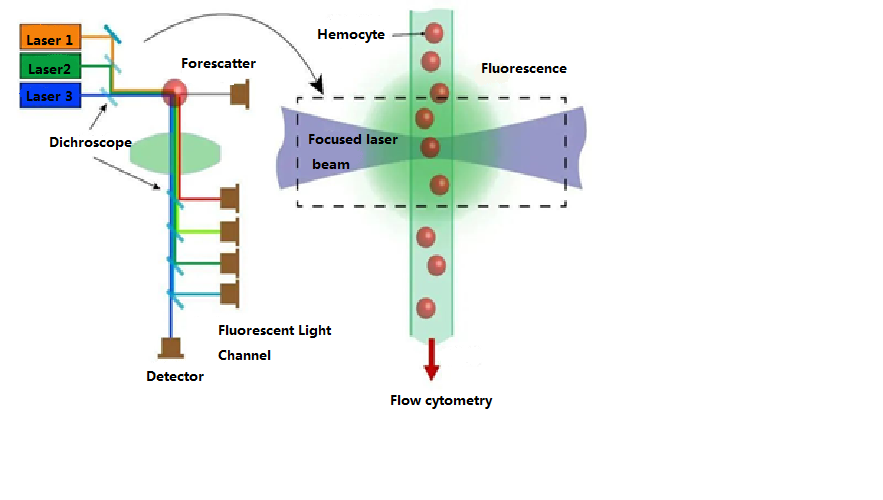
Deux lentilles cylindriques sont situées entre la source laser et la chambre de flux. Ces lentilles focalisent le faisceau laser de section circulaire émis par la source laser en un faisceau elliptique de section plus petite (22 μm × 66 μm). L'énergie laser de ce faisceau elliptique est distribuée selon une distribution normale, garantissant une intensité d'éclairage constante pour les cellules traversant la zone de détection laser. Le système optique, quant à lui, se compose de plusieurs ensembles de lentilles, de sténopés et de filtres, que l'on peut diviser en deux groupes : en amont et en aval de la chambre de flux.
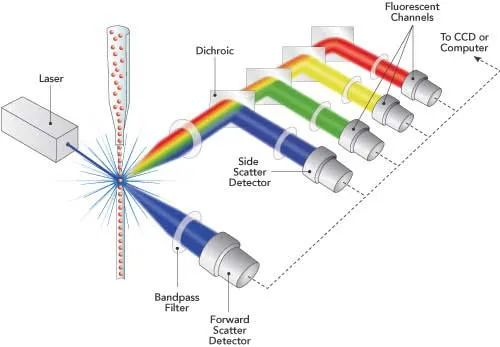
Le système optique situé devant la chambre d'écoulement est constitué d'une lentille et d'un sténopé. La fonction principale de la lentille et du sténopé (généralement deux lentilles et un sténopé) est de focaliser le faisceau laser de section circulaire émis par la source laser en un faisceau elliptique de section plus petite. Cela répartit l'énergie laser selon une distribution normale, garantissant une intensité d'éclairage constante pour les cellules sur toute la zone de détection laser et minimisant les interférences dues à la lumière parasite.
Il existe trois principaux types de filtres :
1 : Filtre passe-long (LPF) - laisse passer uniquement la lumière dont les longueurs d'onde sont supérieures à une valeur spécifique.
2 : Filtre passe-bas (SPF) : il laisse passer uniquement la lumière dont les longueurs d'onde sont inférieures à une valeur spécifique.
3 : Filtre passe-bande (BPF) - laisse passer uniquement la lumière dans une plage de longueurs d'onde spécifique.
Différentes combinaisons de filtres permettent de diriger les signaux de fluorescence de différentes longueurs d'onde vers des tubes photomultiplicateurs (PMT) individuels. Par exemple, les filtres LPF550 et BPF525 permettent de détecter la fluorescence verte (FITC) devant un PMT. Les filtres LPF600 et BPF575 permettent de détecter la fluorescence orange-rouge (PE) devant un PMT. Les filtres LPF650 et BPF675 permettent de détecter la fluorescence rouge (CY5) devant un PMT.

La cytométrie en flux est principalement utilisée pour le tri cellulaire. Avec les progrès de l'informatique, le développement de l'immunologie et l'invention de la technologie des anticorps monoclonaux, ses applications en biologie, en médecine, en pharmacie et dans d'autres domaines se généralisent. Ces applications comprennent l'analyse de la dynamique cellulaire, l'apoptose cellulaire, le typage cellulaire, le diagnostic tumoral, l'analyse de l'efficacité des médicaments, etc.
Date de publication : 21 septembre 2023



